Konumuzda atomların elektron alıp-verme yatkınlığını geniş konu anlatılacak, etkinlik soruları çözümlenecek ve konu soruları cevaplanacaktır.
Elektronların Dizilimi ve Kimyasal Özellikler
Bir markette çalıştığınızı ve görevinizin boş yumurta kartonlarını bir yerde biriktirmek, dolu yumurta kartonlarını ise rafa dizmek olduğunu varsayınız.
Fotoğraftaki yumurta kartonlarını ayrı ayrı doldurmayı mı yoksa birini diğerine aktarmayı mı tercih edersiniz? Aktarmayı isterseniz hangisindeki yumurtaları diğerine eklersiniz? Neden?
Fotoğraftaki yumurta kartonlarını birbirine aktarmayı tercih ederim. Az yumurta olan kartondaki yumurtaları çok yumurta olan kartona aktarırım. Çünkü bana daha az iş çıkaracaktır.
1. Atomların Elektron Alıp-Verme Yatkınlığı
Atomlar arasında elektron alış verişi olduğunu öğrendiniz. Peki bir maddenin elektron alıp verme yatkınlığını belirleyen nedir? Bu durum elektronların atomdaki dizilişleri ile ilgili olabilir mi? Bu soruyu cevaplayabilmek için aşağıdaki etkinliği yapınız:
Bu sorulara http://www.yardimcikaynaklar.com/sorucevap/36/maddenin-elektron-alip-verme-yatkinligini-belirleyen-nedir bu soru cevap bölümünde cevap verildi.
8. ETKİNLİK: He, Ne ve Ar Atomlarının Modellerini Yapalım

Malzeme listesi: Büyük karton (3 adet), üç farklı renkte el işi kâğıdı, makas, 131. sayfadaki atom modelleri
Amaç: Çeşitli elementlerin atom modellerini yaparak hangi atomların elektron alıp vermeye yatkın
olduğunu kavramak
Etkinliğin yapılışı
• 4-5 kişilik gruplar oluşturunuz.
• İlk 20 elementin verilen atom modellerinden yararlanarak He, Ne ve Ar atomlarının modellerindeki atom altı taneciklerin sayısını belirleyiniz.
• Büyük kartonlara atomdaki çekirdeği ve katmanları gösteren çizgiler çiziniz.
• El işi kâğıtlarından küçük daireler şeklinde proton ve nötron, daha küçük olacak şekilde de elektronlar kesiniz.
• Verilen atomların elektron dizilişlerini defterinize yazınız.
• Atom altı tanecikleri temsil eden el işi kâğıtlarını kartonlarda uygun yerlere yerleştiriniz.
Sorular
1. He, Ne ve Ar atom modellerinde her katmana kaç elektron yerleştirdiniz?
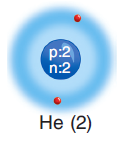
He (2) Helyum elementi aşağıdaki model resimde görüldüğü gibi 1. kamana 2 elektron yerleştirilmiştir.
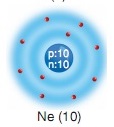
Ne (10) Neon elementinde aşağıdaki model resimde görüldüğü gibi 1. katmana 2 elektron 2. katmana 8 elektron yerleştirilmiştir.
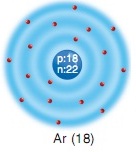
Ar (18) Argon elementinde aşağıdaki model resimde görüldüğü gibi 1. katmanda 2 elektron, 2. katmanda 8 elektron ve 3. katmanda 8 elektron yerleştirilmiştir.
2. He, Ne ve Ar atomlarının ortak yönü nedir?
He (2) Ne (10) ve Ar (18) atomlarının ortak yönü atomlarının son katmanlarının alabileceği en çok elektron almış olmasıdır.
3. Atomdaki son katmanların Düşün-Bul bölümündeki soruda bahsedilen yumurta kartonlarına, elektronların da yumurtaya benzediğini varsayınız. Bu benzetmeye göre He, Ne ve Ar atomlarının elektron alıp vermeye yatkınlığı konusunda ne söyleyebilirsiniz?
Bu benzetmeden bu atomların hiç elektron alıp vermeye yatkınlığının olmadığını söyleyebiliriz.
Atomların son katmanlarındaki elektron sayısı atomun elektron alıp verme yatkınlığı hakkında bize fikir verir. Etkinlikteki helyum (He), neon (Ne) ve argon (Ar)’un son katmanlarındaki elektron sayılarını karşılaştıralım. Yaptığınız etkinlikte de belirlediğiniz gibi helyumun tek elektron katmanı ve bu katmanda iki elektronu vardır. Gördüğünüz gibi neon iki katmana argon ise üç katmana sahiptir ve her ikisinin de son katmanında sekiz elektron vardır. Atomlarda birinci katmanda en fazla iki, 2 ve 3. katmanlarda en fazla sekizer elektronun yer alabileceğini biliyorsunuz. Buna göre helyum, neon ve argon atomlarının son katmanları tam doludur. İlk bakışta He, Ne ve Ar atomları oldukça farklı görünür. Ancak, bu üç atomun elektron dağılımlarındaki benzerlik son katmanlarının tam dolu olmasıdır.
Atomlar son katmanlarını tam dolu hâle getirmeyi tercih eder. Son katmanları tam dolu olan atomlar kararlı hâlde olan atomlar olarak adlandırılır. Bunlar elektron alıp vermeye eğilimli değildir. Bu durumda He, Ne ve Ar atomları elektron alıp vermeye yatkın olmayan kararlı hâldeki atomlardır.
Son katmanları tam dolu olmayan atomların elektron almayı mı yoksa elektron vermeyi mi tercih edeceklerini Bulalım etkinliğini yaparak keşfedelim.
Yukarıdaki atom modellerini inceleyiniz ve verilen soruları cevaplayınız.
1. Son katmanında bir veya iki elektron bulunan atomlar hangileridir?
Son katmanında bir veya iki elektron bulunan atomlar: Lityum, sodyum,magnezyum potasyum, kalsiyum
2. Son katmanlarında bir veya iki elektron bulunan atomlar, bu elektronlarını dışarı verdiğinde geri kalan katmanlar tam dolu olur mu?
Son katmanlarında 1 veya 2 elektron bulunan atomlar, bu elektronlarını verdiğinde kalan katmanları tam dolu olur.
3. Son katmanında bir elektron olan atom, dışarıdan yedi elektron alarak mı yoksa dışarıya bir elektron vererek mi kararlı hâle gelmeyi tercih eder?
Son katmanında 1 elektron olan atom dışarıya elektron vererek kararlı hale gelmeyi tercih eder.
4. Son katmanında altı veya yedi elektron bulunan atomların elektron dizilişini inceleyiniz. Bu atomlar, son katmanlarını nasıl tam dolu hâle getirebilir?
Son katmanında 6 veya 7 elektron bulunan atomlar, dışarıdan elektron alarak tam dolu hale gelir.
5. Bu atomlardan hangisi, kaç elektron vererek veya kaç elektron alarak kararlı hâle geçmeyi tercih eder? Tahmin ediniz ve tahmininizi neye göre yaptığınızı açıklayınız.
Lityum atomu son katmanında 1 elektron var 1 elektron verir, Oksijen son katmanında 6 elektron var 2 elektron alır. Flor son katmanında 7 elektron var 1 elektron alır. Sodyum atomunun son katmanında 1 elektron olduğu için 1 elektron verir. Magnezyum atomunun son katmanında 1 elektron olduğu için 1 elektron verir. Kükürt atomunun son katmanında 6 elektron olduğu için 2 elektron dışarıdan alır. Klor atomunun son katmanı 7 elektron olduğu için dışarıdan 1 elektron alır. potasyum atomunun son katmanı 1 elektron olduğu için dışarıya 1 elektron verir. Kalsiyum atomunun son katmanı 2 elektron olduğu için dışarıya 2 elektron verir.
6. Elektron alarak veya vererek kararlı hâle geçen atomlardan hangisi pozitif (+), hangisi negatif (-) yükle yüklenir? Neden?
Dışarıya elektron veren atomlar pozitif, dışarıdan elektron alan atomlar negatif yükle yüklenir.
Atom numarası üç olan lityum atomunun 1. katmanında iki, 2. katmanında bir elektron vardır. Lityum atomunun 2. katmanının tam dolu olması için dışarıdan yedi elektron alması gerekir. Lityum atomu bunu yapmak yerine bir elektron vererek tek katmanlı hâle gelir. Bu katmanda iki elektron olduğu için de kararlı hâle geçmiş olur. Bir katmanlı ve bir elektronlu hidrojen ile iki katmanlı ancak 2. katmanındaki elektron sayısı az olan atomların elektron alarak veya vererek son katmanlarındaki elektron sayısını ikiye tamamlayıp helyuma benzemesi, böylece kararlı hâle gelmesi dublet olarak adlandırılır. Dublet, ikili elektron takımı demektir. Atom numarası 4 olan berilyum atomu da dublet tercih eder mi Neden? http://www.yardimcikaynaklar.com/sorucevap/38/atom-numarasi-olan-berilyum-atomu-dublet-tercih-eder-neden
Atom numarası 11 olan sodyum atomunun da son katmanında bir elektron vardır. Sodyum atomu argon veya neona benzemek için yedi elektron alarak son katmanını sekize tamamlamak yerine bir elektronunu vererek kararlı hâle gelir. Atomların elektron alarak veya vererek son katmanlarındaki elektron sayısını sekize tamamlaması oktet olarak adlandırılır. Oktet sekizli elektron takımı demektir. Flor atomu da oktet eğiliminde midir? Neden?
Flor atomunun son katmanı yani 2. katmanı 7 elektrondan oluşmaktadır. 1 elektron daha dışarıdan alarak oktet olur.