Her madde, kendi yapısı ve fiziksel halinden dolayı bir miktar enerjiye sahiptir. Kimyasal tepkimeler oluşurken genellikle ısı şeklinde bir enerji değişimi görülür. Bir maddenin sahip olduğu enerji; o maddenin potansiyel ve kinetik enerjileri toplamı olup bu toplam enerjiye maddenin iç enerjisi denir.
Tepkime Isısı : Sabit basınç altında gerçekleşen bir tepkimede alınan veya verilen ısıya tepkime ısısı ya da entalpi denir.
Tepkime ısısı, Ürünlerin toplam ısı kapsamından tepkimeye girenlerin toplam ısı kapsamının çıkarılmasıyla bulunur.

Maddelerin ısı kapsamları, maddelerde var olan titreşim, dönme, öteleme hareketi ile elektriksel etkileşimden kaynaklanan enerjidir.
- Tepkime ısısı kalorimetre denilen kaplarda ölçülür.
- Tepkime ısısı madde miktarına, maddenin cinsine, fiziksel haline, ortamın sıcaklık ve basıncına bağlıdır.
- Sıcaklığın 25 derece, basıncın 1 atmosfer olduğu koşullara standart koşullar denir. Bu koşullardaki tepkime ısısına da standart tepkime ısısı denir.
Tepkime ısısı, tepkimenin türüne göre değişikşe killerde adlandırılabilir. Örneğin; 1 mol bileşik elementlerinden oluşuyorsa alınan ya da verilen ısıya molar oluşma ısısı, asit ve bazın tepkimesi sırasında oluşuyorsa nötürleşme ısısı, 1 mol maddenin yanması sırasındaysa molar yanma ısısı şeklinde adlandırılır.
ÖRNEK 1 ÇÖZÜM 1


- Yalnız başına bulunan elementlerin oluşma ısıları sıfır kabul edilir.
- Çekirdek tepkimelerinde açığa çıkan enerji, kimyasal tepkimelerde açığa çıkan enerjiden o da fiziksel olaylar sırasında açığa çıkan enerjiden daha büyüktür.


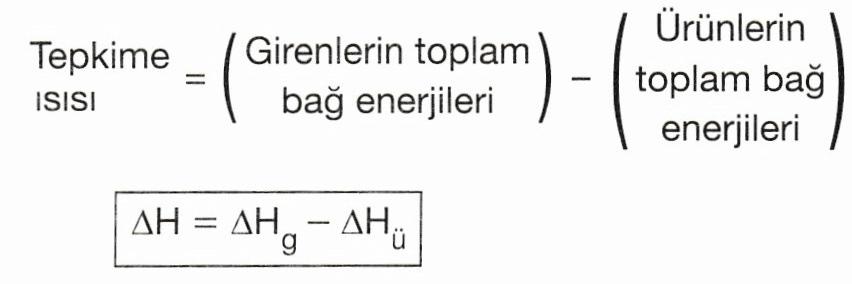
NOT: Kimyasal tepkimelerin ısısı, bağ enerjileri kullanılarak da hesaplanabilir. Bağ oluşurken enerji açığa çıkar, bağ koparılırken dışarıdan enerji alınır.
Bağ enerjilerinden yararlanarak tepkime ısısı hesaplanırken, girenlerin toplam bağ enerjilerinden, ürünlerin toplam bağ enerjileri çıkarılır.